La energía de activación mide la dferencia de entalpía entre el complejo activado y los reactivos.
En 1899 Arrhenius propuso un interpretación cuantitativa de la variación de la velocidad de reacción con la temperatura. Propuso para la constante específica de velocidad la siguiente expresión:
siendo R la constante de los gases, A una constante llamada factor de frecuencia y Ea la energía de activación. Esta ecuación puede interpretarse de acuerdo con la teoría del complejo activado.
El factor de frecuencia A mide el número de choques con la orientación adecuada, mientras 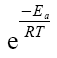 determina la fracción de moléculas que superan la energía de activación.
determina la fracción de moléculas que superan la energía de activación.
El factor exponencial es responsable de que ante un aumento de la temperatura la velocidad de reacción aumente mucho. Esto se debe a que el número de moléculas que superan la energía de activación aumenta con la temperatura.


