|
Medidas muy precisas de conductividad en agua bidestilada muestran que tiene cierta conductividad, lo que indica la presencia de iones en la misma. La ionización del agua se puede representar mediante la ecuación:
| H2O |
+ |
H2O |
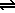 |
H3O+ |
+ |
OH- |
| Ácido1 |
|
Base2 |
|
Ácido2 |
|
Base1 |
que recibe el nombre de autoionización (según el concepto de Arrhenius) o autoprotólisis (según el concepto de Brönsted).
Teniendo en cuenta que la concentración del agua es prácticamente constante (55.5 M), puede incluirse en la constante de equilibrio, que se expresa entonces del siguiente modo:
kw = [H3O+][OH-]=1.0·10-14 (a 25 ºC)
Esta constante se llama producto iónico del agua. |


