|
MODELO ATÓMICO DE BOHR |
||
|
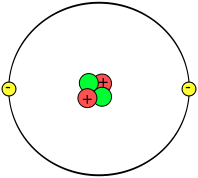
O físico danés Niels Bohr realizou unha serie de estudos dos que deduciu que os electróns da codia xiran ao redor do núcleo describindo só determinadas órbitas circulares.
No átomo, os electróns organizaranse en capas e, en cada capa terán unha certa enerxía, enchendo sempre as capas inferiores e despois as superiores. Na seguinte escena pode observarse a representación dos átomos dos 12 primeiros elementos da táboa periódica con este modelo:
|
|
A distribución dos electróns nas capas denomínase configuración electrónica e realízase da seguinte maneira: A 1ª capa pode conter, como máximo, 2 electróns. A 2ª capa pode conter, como máximo, 8 electróns. Comeza a encherse unha vez que a 1ª xa está completa. A 3ª capa pode conter, como máximo, 18 electróns. Comeza a encherse unha vez que a 2ª capa xa está completa. Represéntase por números separados por comas e entre parénteses. Por exemplo, a átomo de sodio ten 11 electróns; polo tanto, 2 enchen a 1ª capa, 8 quedan na 2ª capa e o último electrón quedaría na 3ª capa. A representación é: (2,8,1). |