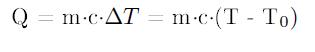
2.1 Cambios de temperatura
Planteémos la siguiente pregunta, ¿cuánto calor tengo que dar para que varie la temperatura de un cuerpo lo que yo quiera? La respuesta ha esta pregunta está enlazada con la definición de calor específico.
El calor específico de una sustancia es el calor que debe recibir dicha sustancia para subir su temperatura 1K.
El calor específico depende de la naturaleza de la sustancia que estemos calentando.
Ahora bien, ¿De qué depende el calor que absorve o cede un cuerpo?
Para responder a esta pregunta razonemos un poco, evidentemente el calor total que pueda absorver o ceder un cuerpo dependerá del calor específico ya que este me dice lo que me “cuesta”(en términos de calentar o enfriar) subir o bajar 1 Kelvin de temperatura.
Por otro lado, ¿Desprenderán el mismo calor un plato con 1kg de patatas fritas recién hechas que 10 kg de las mismas patatas?
Y finalmente, ¿costará lo mismo calentar 1kg de hielo de 10 grados bajo cero a 25ºC que 1kg de agua de 20ºC a también 25ºC?
Bien, la experiencia nos dice que la respuesta a las dos últimas preguntas en negativa con lo cual el calor que puede absorver o desprender un cuerpo dependerá de la masa que tenga y de la variación de temperatura que tenga que sufrir.
En términos matemáticos:
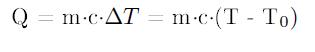
Ya que la diferencia de temperatura genera un flujo de calor del cuerpo que tiene más temperatura al que tiene menos. En base a esta afirmación se define equilibrio térmico como la situación en la cual dos o más cuerpos llegan a tener la misma temperatura.
Utilizando el principio de conservación de la energía, el calor que se cede tiene que ser el mismo que el que se absorve. Matemáticamente hablando tenemos:
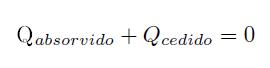
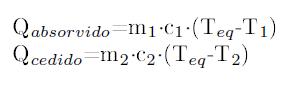
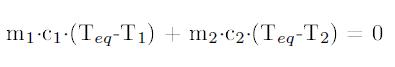
El subíndice 1 hace referencia a la sustancia que tiene menos temperatura “sustancia fría” y el subíndice 2 hace referencia a la sustancia que tiene más temperatura “sustancia caliente”.
![]()
Teq → Es la temperatura final con la que acaban las dos sustancias
Realiza los ejercicios de la siguiente simulación: